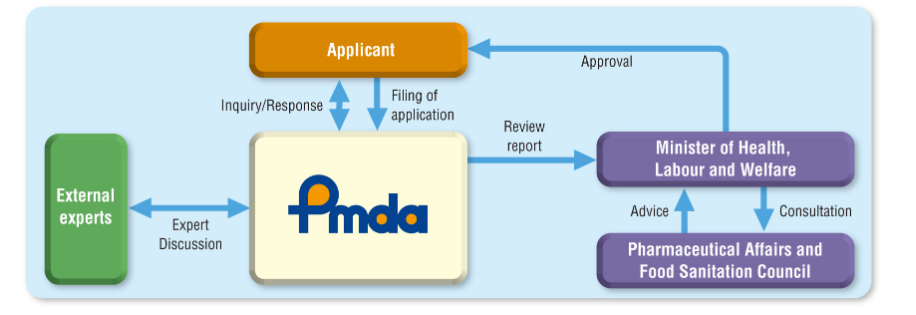
有关医疗器械等外国制造业者的注册申请事宜
对于外国的拟向日本出口医疗器械及体外诊断用医药品的制造厂家,为确保其医药品,医疗器械等的品质、有效性及安全性,根据相关法律(药品医疗器械法),称其为医疗器械等外国制造业者,与在日本国的制造业者同样,根据医药品医疗器械法实行规则第114条的8各项规定的制造工程相关联的外国制造业者需要按照医药品医疗器械法第23条的2-4的规定注册,此为该医疗器械等制造销售认证的条件。
外国制造业者的注册由厚生劳动大臣审批。
注册申请之前,需要取得此外国制造业者及制造所的业者号码并登记。
有关外国制造业者的注册手续,可由该外国制造业者制造的医疗器械等的在日本的制造销售业者做代理办理,但是申请者的身份是外国制造业者。因此注册申请后作为在日本厚生劳动省注册的制造业者,其产品可以由日本的所有的制造销售业者来经营销售。注册证是归于贵社工厂的。
并且,注册的有效期限为5年,之后需要更新。
注册申请需要的资料(医药品医疗器械法实施规则第114条的15-2项)
1.申请人(如果申请人是法人,应为经营负责人)说明没有根据医疗器械法第5条第3号例举的内容的资料(没有违法犯罪记录的宣誓书)。
2.制造所得负责人得履历书资料。
3.能够说明证明制造所的住所的地图(显示并能确认制造所的范围,周围道路的正确情况的资料图)
有关在日本申请 ClassⅡ医疗器械的事宜
○属于Ⅱ类医疗器械,由专门的指定的认证机关审核,需要事先做成资料,提出后接受审核。商品的STED及其他资料。并且需要接受QMS的适合性调查。本公司已经接受过QMS适合性认证,但海外的制造业者需要接受QMS适合性调查。
QMS适合性认证要求有ISO-13485,及如果有其他的资质证明,对调查有利。
申请要求,品质操作手册(Manual)、材质的国家食品药品监督管理局发行的检验报告书等资料的复印件及日语翻译。
届时需要注意的是,用日本的公司名申请制品的医疗器械销售认证,将会无法变更代理店。因此,建议申请外国制造医疗器械制造销售认证(以贵社自己的名义来申请)。
在日本的申请,由选任的外国制造医疗器械等制造销售业者来实行。日本的制造销售业者是由贵方选任的,取得认证后可以变更。



















 18576401396
18576401396 





