制定机构:
澳大利亚 —— 治疗用品管理局(TGA)
巴西 —— 国家卫生监督局(ANVISA)
加拿大 —— 加拿大卫生部(Health Canada/Santé Canada)
日本 —— 厚生劳动省(MHLW)与药品医疗器械局(PMDA)
美国 —— 食品药品监督管理局(FDA)
1. 范围
《MDSAP 质量管理体系手册》规定了 MDSAP 需遵循的要求,以实现以下目标:
・证明其有能力持续提供满足顾客及适用法规要求的服务;
・通过质量管理体系(QMS)的有效应用提升顾客满意度,包括 MDSAP 体系的持续改进流程,以及确保符合顾客及适用法规要求的保障措施。

在 MDSAP 内部推行质量管理体系,有助于 MDSAP 在以下关键关注领域实现其主要宗旨与目标:
・流程管理
・沟通协调
・组织有效性与效率
MDSAP 参与者认为,质量管理体系的制定、实施与维护,将提升所有 MDSAP 参与者、工作人员、顾客(内部与外部)及相关方在决策过程中的参与度,并最大限度提升 “为所有 MDSAP 参与者提供优质产品与服务” 所涉及流程的有效性。
通过实施质量管理体系(QMS)的政策与程序,医疗器械单一审核计划(MDSAP)可实现两大功能:1)设计与开发 “与 MDSAP 使命相关的流程、产品及服务”(含关键管理与行政支持服务);2)持续改进并强化 MDSAP 产品与服务质量。《MDSAP 质量管理体系手册》是理解 MDSAP 质量管理体系的核心组件,旨在提供清晰的组织指导。MDSAP 参与者有责任熟练掌握并参与 MDSAP 质量管理体系(QMS)的相关工作。
在设计与实施质量管理体系时,MDSAP QMS 需明确以下内容:1)顾客明确提出及隐含的需求;2)工作流程与产品需遵循的适用法规要求;3)所有 MDSAP 参与者识别的其他要求。
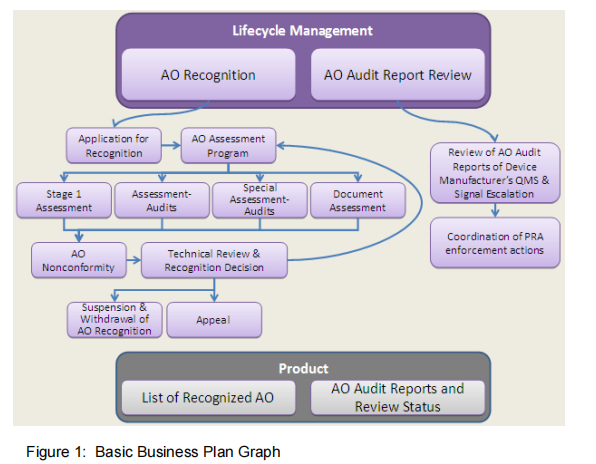
MDSAP 质量管理体系的目标是提升 MDSAP 产品与服务的质量。为实现该目标,MDSAP 将采用 “基于 ISO 18091:2014《质量管理体系 ——ISO 9001:2008 在地方政府的应用指南》的过程导向型质量管理体系”,对已识别的 MDSAP 流程进行管理。本手册规定了 “在质量管理体系框架内,为管理‘向顾客及相关方提供产品与服务所涉及的已识别流程’、满足 ISO 9001:2015 标准要求” 需开展的工作。MDSAP 参与者在执行基本业务计划中的角色如下图所示



















 18576401396
18576401396 





